中性粒细胞胞外诱捕网促使肾结石形成


2024年11月,中南大学湘雅医院湘雅国际医学中心老年泌尿外科张晓波教授团队于《Kidney Dis (Basel)》 (Q1,IF,3.2)杂志上发布了文章“Neutrophil Extracellular Traps Drive Kidney Stone Formation”。该研究发现:
①西维可明显减轻肾损伤,并通过抑制大鼠 NETs 的形成来抑制肾结石的发展。西维来司他钠能使肾结石大鼠体内增加的钙沉积、凋亡细胞和肾小管损伤均得到改善,能提高肾结石大鼠的 SOD 活性,降低 MDA、Cr、BUN 和钙的水平,从而改善肾功能。
②肾结石患者血浆中的cf-DNA、MPO-DNA、H3Cit和NE浓度升高,DNase I水平降低,肾乳头组织显示 MPO 和 H3Cit 含量增加。血红素和伊红(H&E)染色显示,肾结石患者的肾脏发生了明显的病理变化,包括上皮细胞坏死、肾小管扩张和单核细胞浸润。
③NETs能促进肾结石的形成,从而加重肾损伤。我们的研究发现,NETs 是一种潜在的肾结石诊断和治疗生物标志物。

目的:本研究旨在探讨中性粒细胞胞外诱捕网(NETs)对肾结石的贡献。
方法:应用 GSE73680 微阵列数据和生物信息学分析鉴定肾结石患者的差异表达基因。通过乙二醇和lǜ化铵给药建立了肾结石大鼠模型。收集血浆以检测 cf-DNA、DNase I、MPO-DNA、H3Cit 和 NE。通过生化分析检测超氧化物歧化酶、丙二醛、肌酐、血尿素氮和钙。通过免疫荧光染色检测肾组织中的 MPO、H3Cit 和 NE。细胞凋亡通过 TUNEL 检测进行评估。HE、Periodic Acid-Schiff 和 Von Kossa 染色用于确定肾脏的组织结构、钙沉积和结石形成。对大鼠使用中性粒细胞弹性蛋白酶抑制剂西维来司他钠(西维)以抑制NETs。
结果:共鉴定出 403 个差异表达基因,包括 270 个上调基因和 133 个下调基因。对这些表达失调的基因进行了基因本体富集、KEGG通路和蛋白-蛋白相互作用网络分析。此外,我们还观察到肾结石患者体内 cf-DNA、DNase I、MPO-DNA、H3Cit 和 NE 等 NETs 标志物以及钙沉积物的增加。随后,我们建立了肾结石大鼠模型。我们发现,随着肾结石的发展,肾结石大鼠体内NETs的形成明显升高,肾小管损伤和细胞凋亡加剧。令人震惊的是,我们发现通过西维抑制 NETs 可显著减少钙沉积和细胞凋亡,减轻肾小管损伤,从而改善肾功能。
结论:NETs能促进肾结石的形成,从而加重肾损伤。我们的研究发现,NETs 是一种潜在的肾结石诊断和治疗生物标志物。

肾结石又称泌尿系结石或肾结石,是肾脏中形成的矿物质沉积,有四种类型:钙、尿酸、硬石和胱氨酸,是一种非常常见的泌尿系统疾病,全球约有超过 10%的人患有此病。肾结石可能会导致腰部剧痛、血尿、发烧和发冷,数百年来一直困扰着人类。重要的是,人们注意到肾结石与心血管疾病和慢性肾脏疾病等严重疾病的风险增加有关。肾结石的治疗方法,如肾镜碎石术、冲击波碎石术和经皮肾镜碎石术,已经取得了很大进展。然而,如何预防肾结石复发仍是一个严峻的问题。因此,更好地了解肾结石形成和发展的机制对肾结石的预防和治疗具有重要意义。
中性粒细胞胞外诱捕网(NETs)是由DNA、组蛋白和颗粒蛋白质组成的胞外染色质纤维网。受刺激的中性粒细胞挤出的 NETs 可捕获并杀死入侵的微生物。此外,新的证据显示,NETs 是导致各种疾病的关键因素。例如,Yang 等人发现,结肠癌和乳腺癌患者肝转移灶中的 NETs 形成增加,NETs 通过 CCDC25 吸引肿瘤细胞促进癌症转移。Nakazawa 及其同事报告,NETs 通过释放组蛋白和细胞因子加剧了肾损伤和远处器官功能障碍。NETs 有助于胆结石的形成,但 NETs 参与肾结石的情况仍不清楚。之前的一项研究发现,刷状肾结石中中性粒细胞浸润和 NETs 增加,可能会促进患者的炎症反应,提示其与肾结石有关。
中性粒细胞弹性蛋白酶(NE)是中性粒细胞中富含的一种丝氨酸蛋白酶,具有破坏性弹性蛋白酶的功能,可破坏细胞外基质,调节炎症和组织重塑。NE 在转位到细胞核后会降解组蛋白,并促进 NETs 形成所需的染色质解聚。NE与炎症性疾病、慢性肾脏和肺部疾病有关,而NETs相关的NE在肾结石中的作用尚未见报道。
因此,NETs 与肾结石形成之间的关系是一个谜。揭示NETs参与肾结石的机制加深了人们对肾结石发病机制的认识。在这里,我们证明了NETs在肾结石患者和大鼠体内含量丰富,阻断NETs可抑制肾结石的形成和发展。我们的研究结果为肾结石的发病机制提供了新的见解,并表明靶向NETs可能有益于肾结石的预防和治疗。

1 .肾结石患者体内的失调基因
为了探究肾结石的潜在调控因子,我们分析了GSE73680的芯片数据,发现了403个差异表达基因,其中包括270个上调基因和133个下调基因(图1a)。此外,生物过程术语的 GO 富集分析和 KEGG 通路分析表明,这些差异表达基因与嗅觉信号通路、G alpha (S) 信号事件、细胞外基质降解、细胞外基质组织、GPCR 信号转导、GPCR 下游信号转导、ECM 蛋白多糖和胶原降解密切相关(图 1b,c)。此外,我们将这些差异表达基因提交给 STRING 重建蛋白-蛋白相互作用网络(图 1d),并根据 cytoHubba 插件计算的程度得分确定了前 10 个中心基因,包括 CAV1、TGFB3、FBN1、COL4A2、COL6A1、SERPINH1、SPARC、MMP1、NID1 和 FN1(图 1e)。
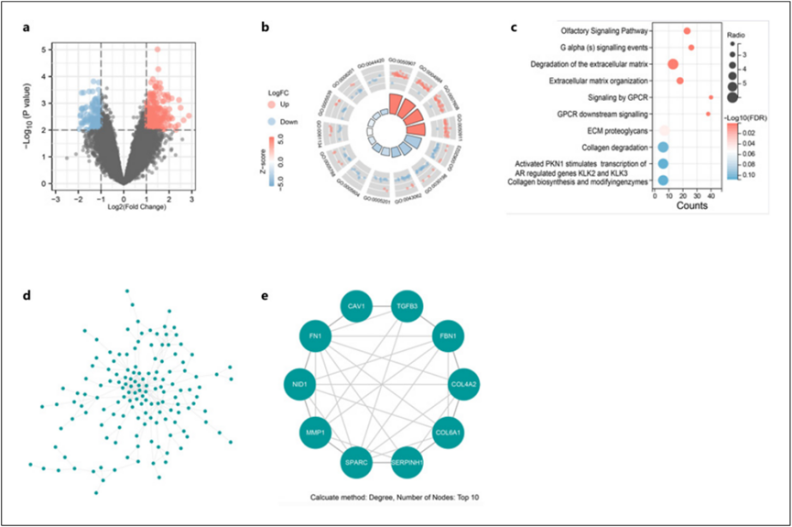
图 1. 肾结石患者的失调基因。a 微阵列数据的火山图;b, c 差异表达基因的 GO 富集和 KEGG 通路分析;d 通过 STRING 构建了 PPI 网络;e 通过 cytoHubba 插件确定了十大枢纽基因。PPI,蛋白质-蛋白质相互作用。
2 .肾结石患者NETs升高
鉴于上述分析表明肾结石涉及细胞外基质的组织和降解,而NETs的重要成分之一NE具有破坏细胞外基质的弹性蛋白酶功能,因此我们的研究重点是探讨NETs在肾结石中的作用。NETs由NE、MPO、cf-DNA和组蛋白(如H3Cit)组成,它是循环cf-DNA的主要来源。因此,为了识别 NETs,我们检测了肾结石患者和遭受外伤需要进行肾切除术的对照组患者血浆中 cf-DNA、DNase I、MPO-DNA、H3Cit 和 NE 的水平。与对照组患者相比,肾结石患者血浆中的cf-DNA、MPO-DNA、H3Cit和NE浓度升高,DNase I水平降低(图2a-e)。此外,肾结石患者的肾乳头组织显示 MPO 和 H3Cit 含量增加(图 2f)。血红素和伊红(H&E)染色显示,肾结石患者的肾脏发生了明显的病理变化,包括上皮细胞坏死、肾小管扩张和单核细胞浸润(图2g)。这些结果表明,NETs 的形成增强,可能与肾结石有关。
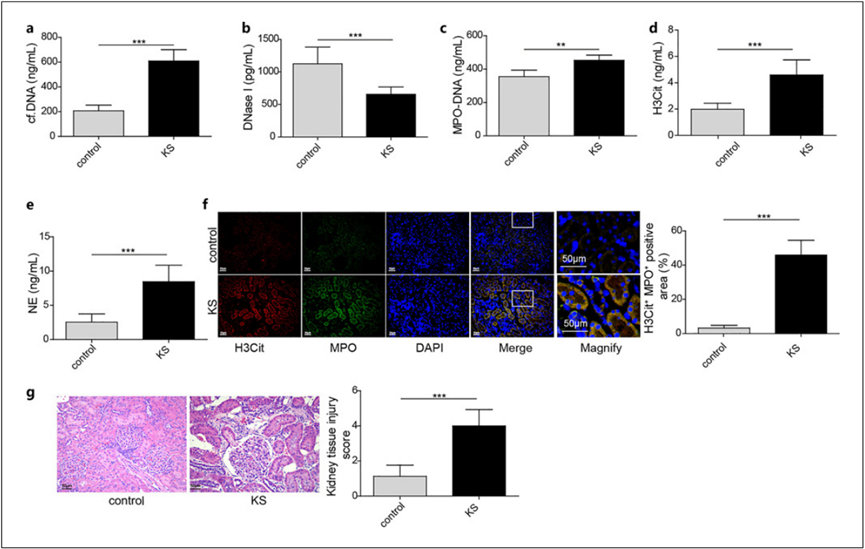
图 2. 肾结石患者的 NETs 升高。a-e 血浆中 cf-DNA、DNase I、MPO-DNA、H3Cit 和 NE 的水平(n = 20);f 肾乳头组织中 H3Cit(红色)和 MPO(绿色)的 IF 染色。g 肾乳头组织的 H&E 染色。**p < 0.01 和 ***p < 0.001。IF,免疫荧光。
-
实验性肾结石大鼠体内NET形成增强
为了评估NETs对肾结石形成和发展的作用,我们通过灌胃乙二醇和lǜ化铵建立了肾结石大鼠模型。实验大鼠的肾脏出现了明显的病理变化,如肾小管扩张和坏死(图 3a)。Von Kossa 和 TUNEL 染色显示肾脏中钙沉积和细胞凋亡明显增加(图 3b、c)。此外,实验性肾结石大鼠肾裂解物中的 SOD 活性降低,MDA 含量增加,血 Cr、BUN 和钙水平升高(图 3d),表明肾结石大鼠的肾功能受损。与对照组大鼠相比,图 1e 中确定的前 10 个基因被证实在肾结石大鼠的肾脏中上调(图 3e)。这些观察结果表明,肾结石大鼠模型已成功建立。
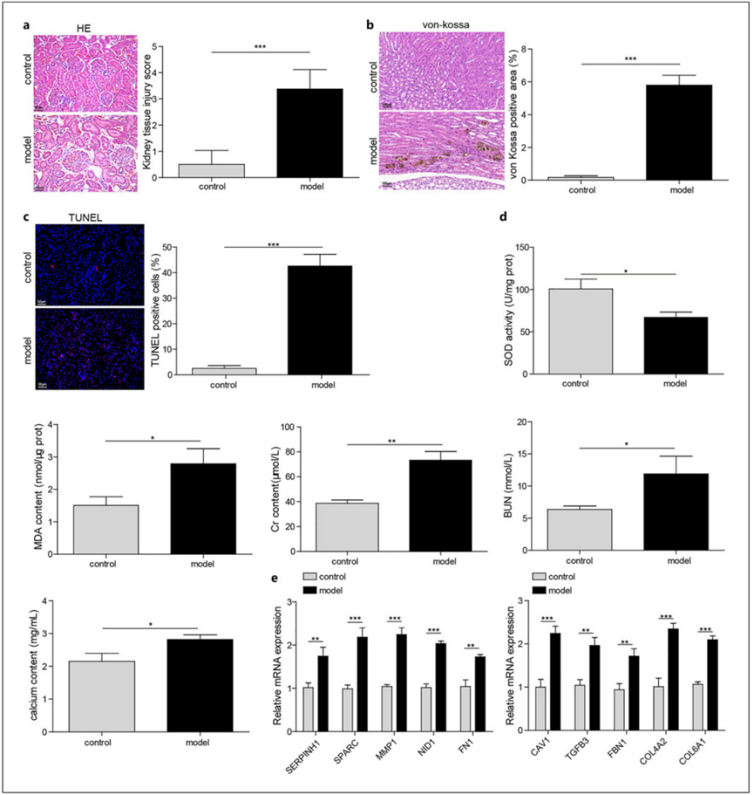
图 3. 通过乙二醇和lǜ化铵给药成功建立了大鼠肾结石模型。a H&E 染色检查肾脏损伤;b Von Kossa 染色测定肾组织中的钙沉积;c TUNEL 染色分析肾组织中的细胞凋亡。e qRT-PCR 分析 CAV1、TGFB3、FBN1、COL4A2、COL6A1、SERPINH1、SPARC、MMP1、NID1 和 FN1 的相对表达。*qRT-PCR,实时定量反转录 PCR。
重要的是,我们发现随着大鼠肾结石的形成,血浆中 cf-DNA、MPO-DNA、H3Cit 和 NE 的水平升高,DNase I 的水平降低(图 4a-e)。此外,H3Cit 和 NE 丰度的增加表明,随着大鼠肾结石的发展,肾脏中 NETs 的形成增强(图 4f)。通过 PAS 和 TUNEL 染色法测定,随着肾结石的形成,肾小管损伤和细胞凋亡明显增强(图 4g,h)。因此,我们的研究结果表明,实验性肾结石大鼠肾脏中的 NETs 数量增加。
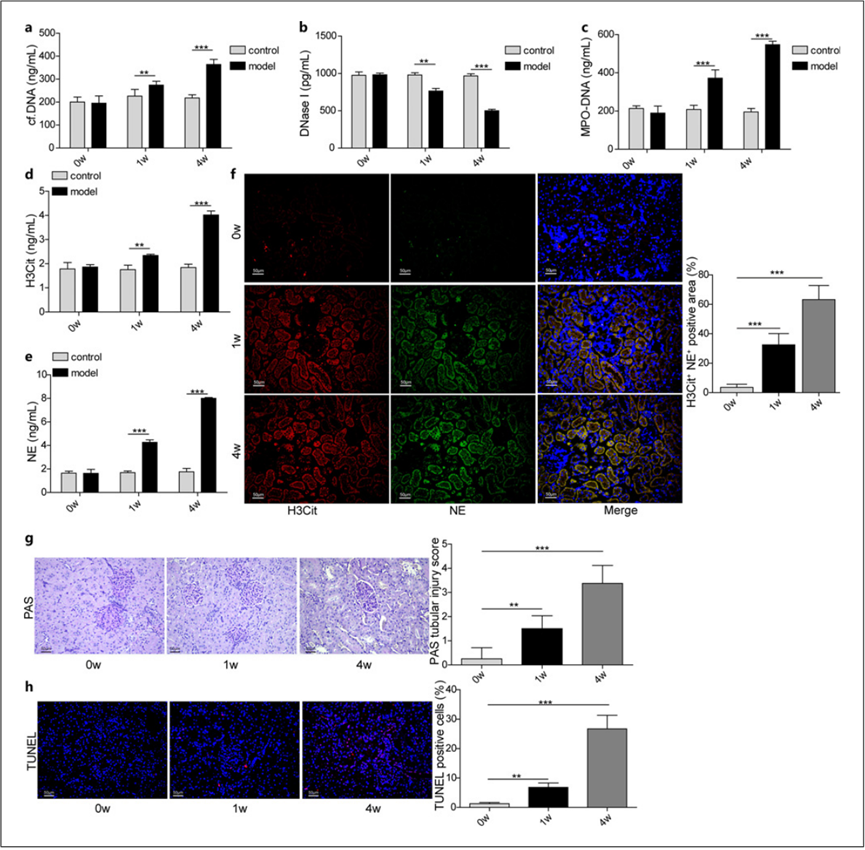
图 4. 实验性肾结石大鼠的 NETs 形成增强。a-e 0 w、1 w 和 4 w 大鼠血浆中 cf-DNA、DNase I、MPO-DNA、H3Cit 和 NE 的水平(n = 8);f 0 w、1 w 和 4 w 肾组织中 H3Cit(红色)和 NE(绿色)的 IF 染色。g PAS 染色检测 0 w、1 w 和 4 w 肾小管损伤情况。 h TUNEL 染色分析 0 w、1 w 和 4 w 肾组织细胞凋亡情况。 **p < 0.01 和 ***p < 0.001。
4 .抑制 NETs 可改善肾结石和肾损伤
此外,通过腹腔注射NET抑制剂西维来司他钠(西维)来抑制肾结石大鼠的NETs,以评估抑制NETs是否会调节肾结石的发生。大鼠分为三组: PBS组、模型 + PBS组和模型 +西维组。使用西维来司他钠后,cf-DNA、MPO-DNA、H3Cit和NE水平升高以及DNase I水平降低的情况得到逆转(图5a-e)。此外,西维还抑制了肾结石大鼠肾脏中 H3Cit 和 NE 表达的增加(图 5f)。这些数据证实了西维能抑制肾结石大鼠体内 NETs 的形成。
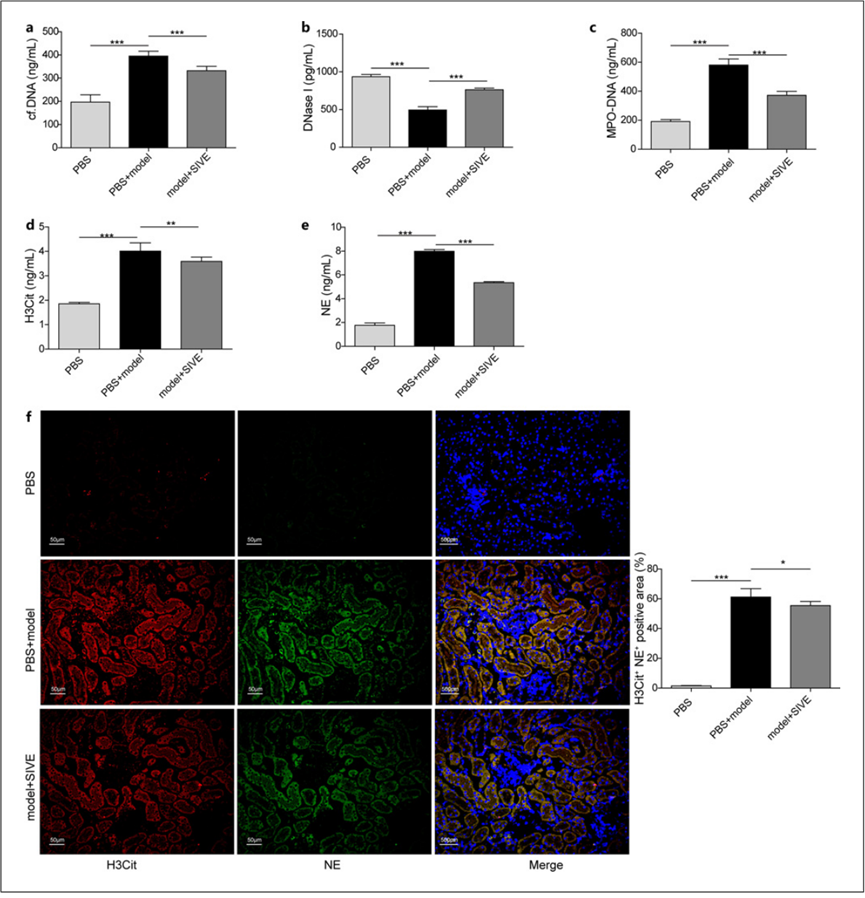
图 5. 通过给大鼠注射西维抑制 NETs。给实验性肾结石大鼠注射西维以阻断 NETs,并将其分为三组:PBS 组、模型 + PBS 组和模型 +西维组: a-e 4 w时大鼠血浆中cf-DNA、DNase I、MPO-DNA、H3Cit和NE的水平(n = 8);f 4 w时肾组织中H3Cit(红色)和NE(绿色)的IF染色;细胞核(蓝色)用DAPI染色。*p < 0.05,**p < 0.01 和 ***p < 0.001。
H&E染色显示,与PBS组相比,模型+PBS组大鼠肾脏检测到肾损伤,而西维明显减轻了肾损伤(图6a)。此外,使用西维后,肾结石大鼠体内增加的钙沉积、凋亡细胞和肾小管损伤均得到改善(图 6b-d)。西维还能提高肾结石大鼠的 SOD 活性,降低 MDA、Cr、BUN 和钙的水平(图 6e),从而改善肾功能。总之,通过西维抑制 NETs 可以抑制肾结石的发展。
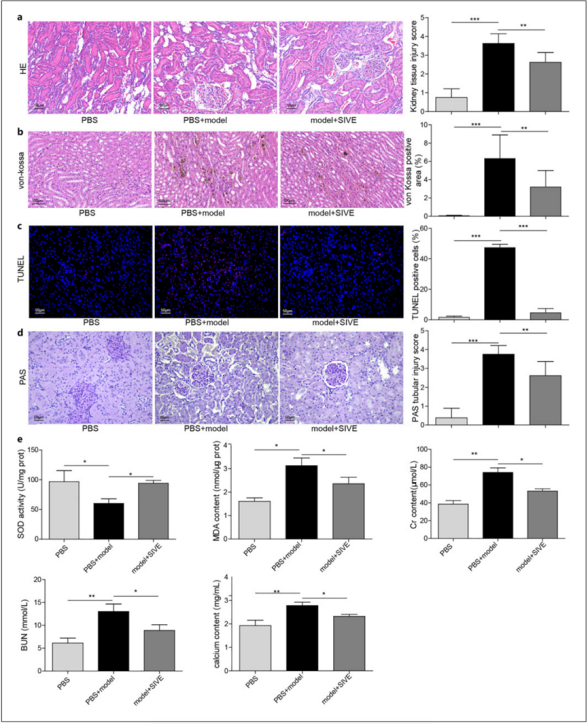
图 6. 抑制 NETs 可改善肾结石和肾损伤。给实验性肾结石大鼠注射西维以阻断 NETs,并将其分为三组: a 4 w 肾组织 H&E 染色;b 4 w Von Kossa 染色测定钙沉积;c 4 w TUNEL 染色分析细胞凋亡;d 4 w PAS 染色检测肾小管损伤;e 4 w 测定肾组织 SOD 活性和 MDA 以及 4 w 血液中 Cr、BUN 和钙(n = 8)。*P < 0.05,**P < 0.01,***P < 0.001。

肾结石是一种常见的泌尿系统疾病,严重影响着全球患者的健康和生活质量。肾结石可导致剧烈疼痛、肾脏感染、肾功能受损和肾积水,肾结石引起的肾绞痛是一种常见的急症,给急诊科带来了沉重的负担。肾结石的发病率在全球范围内稳步上升,例如,在过去 30 年中,中国大陆的发病率从 5.95% 上升至 10.63%。由于现代疗法的发展,肾结石可以得到有效治疗。遗憾的是,肾结石的复发率极高。近一半的患者在 5-10 年内复发,20 年内的复发率约为 75%。目前还没有有效的药物可以预防其复发。肾结石是医学界已知的最古老的疾病之一,但结石的形成和发展机制在很大程度上仍然未知,尽管已发现尿酸、肾小管细胞损伤和凋亡、氧化应激和大分子等各种因素是肾结石形成的多个过程中的重要因素。此外,NETs 可能会诱发氧化应激,进而导致细胞外基质蛋白的积累,提示氧化应激在肾结石中的暗示作用。因此,进一步探索肾结石形成的发病机制对于开发新的管理和预防方法至关重要。在本研究中,我们发现 NETs 是导致肾结石的一种新机制。特别是,我们证实了肾结石患者体内NETs的形成增高,并且阻断NETs抑制了实验性大鼠肾结石的形成和发展,为靶向NETs可能是预防和治疗肾结石的一种潜在方法提供了证据。
2004 年,NETs 首次被发现是一种由过度活化的中性粒细胞释放的网状结构,能够吞噬和杀死入侵的细菌。随后的研究进一步证明,NETs 是宿主防御的关键因素。Bianchi 等人报告称,一种针对慢性肉芽肿疾病患者的特异性基因疗法具有抗真菌活性,并通过重建 NETs 的形成控制曲霉菌病。另一方面,新的证据表明,在各种病理情况下,异常的 NETs 也表现出有害的活性。NETs 通过提供支架和刺激,将炎症和血栓形成联系起来,从而促进血栓形成。Wong 及其同事发现,糖尿病会增强 NETs 的形成,随后 NETs 会损害糖尿病患者的伤口愈合。此外,NETs 可促进肿瘤转移、生长和恶化。此外,NETs 还与狼疮性肾炎和急性肾损伤等多种肾脏疾病有关。然而,其在肾结石中的作用尚未见报道。在这里,我们观察到肾结石患者和实验性肾结石大鼠体内的 NETs 形成增加,这表明 NETs 与肾结石的形成和发展之间存在联系。
靶向 NETs 在治疗疾病方面显示出巨大的潜力。例如,通过血栓调节蛋白抑制 NETs 可以防止胰腺癌的肝转移。Adrover等人发现,双硫仑通过抑制啮齿动物NETs的形成,减轻了急性肺损伤,保护了SARS-CoV-2感染。西维给药可通过抑制 NETs 的形成,改善小鼠肺损伤和内毒素休克,预防疟疾相关急性肺损伤。因此,我们用西维治疗肾结石大鼠,证实给予西维可有效减少 NETs 标志物,表明西维可抑制大鼠 NETs 的形成。重要的是,我们证实阻断 NETs 可减少 CaOx 晶体沉积、细胞凋亡和肾小管损伤,改善肾功能。总之,西维介导的对NETs的抑制作用抑制了肾结石,表明西维可能作为NETs的抑制剂用于预防和治疗肾结石。

总之,我们证明了NETs与肾结石的形成过程有关,并确定NETs是导致肾结石进展的重要调节因子。通过使用西维抑制NETs可显著缓解大鼠肾结石。因此,NETs 有可能成为治疗靶点,西维和双硫仑等NETs抑制剂可用于治疗肾结石。然而,阻断NETs抑制肾结石形成的机制还有待于今后的研究揭示。

1. 临床样本
患者分为肾结石组和对照组。肾结石组 20 例患者均在湘雅医院确诊为肾结石,并接受了经皮肾镜取石术。对照组中,20 名患者因外伤接受了肾切除术。对照组患者无肾结石病史,通过肾脏、输尿管、膀胱平片和超声波检查未发现尿路结石。本研究排除了肾功能衰竭、慢性腹泻、尿道炎、髓质海绵肾、肾小管酸中毒、高钙血症、高尿酸血症、甲状旁腺功能亢进、肾积水、泌尿系统感染和癌症患者。收集了肾结石患者和对照组患者的一般特征,在性别比例和年龄等一般特征方面未发现明显差异。收集肾结石患者和对照组患者的外周血和肾乳头组织。血液在 4°C 下以 2,000 g 离心 10 分钟制备血浆。肾组织在 4% 多聚甲醛溶液中固定过夜,然后进行石蜡包埋和 5 微米切片。患者均已知情并提供了书面知情同意书。我们的研究获得了湘雅医院伦理委员会的批准(批准号:20210045)。
2. 芯片数据分析
我们从基因表达总库(Gene Expression Omnibus)(https://www.ncbi.nlm.nih.gov/geo/)下载了GSE73680数据集,包括肾结石患者(56人)、无肾结石患者(6人)和无肾结石对照患者的乳头组织,并按照之前的描述进行了分析。利用R软件中的limma软件包确定了包括270个上调基因和133个下调基因在内的差异表达基因,并生成了这些基因的火山图。使用 R 软件中的 clusterProfiler 软件包对差异表达基因进行了基因本体(GO)富集分析。此外,还利用 Reactome Pathway Database 进行了京都基因组百科全书(KEGG)通路分析。通过STRING重建了差异表达基因的蛋白-蛋白相互作用网络,并根据cytoHubba插件计算的程度得分确定了前10个枢纽基因,包括CAV1、TGFB3、FBN1、COL4A2、COL6A1、SERPINH1、SPARC、MMP1、NID1和FN1。
3. 大鼠实验性肾结石
实验性肾结石的建立如前所述。雄性 Sprague Dawley 大鼠(8-10 周龄;200-250 克)由斯莱克精达实验动物技术公司(中国湖南长沙)提供,在专门的动物设施中饲养,随机分为不同的组。在图 3 和图 4 中,大鼠被分为对照组和模型组;在图 5 和图 6 中,大鼠被分为 PBS 组、模型 + PBS 组和模型 +西维来司他钠(西维)组。模型组大鼠灌胃 2 mL lǜ化铵(1%)和乙二醇(1%)以诱导肾结石,连续灌胃 4 周。对照组大鼠接受 2 毫升饮用水。在第 0 周(w)、第 1 周(w)和第 4 周(w)收集大鼠外周血,并将大鼠处死,切除肾脏以检测超氧化物歧化酶(SOD)和丙二醛(MDA),并进行石蜡包埋。动物实验程序经湘雅医院伦理委员会批准(批准号:2022020236)。
4. NET 生物标志物的测定
使用 Quant-iT™ PicoGreen™ dsDNA 检测试剂盒(Thermo Fisher Scientific, Waltham, MA, USA),按照说明书测定血浆中的无细胞 DNA(cf-DNA)水平。使用以下酶联免疫吸附试验(ELISA)试剂盒检测血浆中 NE、H3Cit 和 DNase I 的水平: 大鼠 NE 酶联免疫吸附试剂盒(Cusabio,Houston,Texas,USA)、人 NE 酶联免疫吸附试剂盒(Cusabio)、EpiQuik™ 循环组蛋白 H3 瓜氨酸化酶联免疫吸附试剂盒(Epigentek,Farmingdale,NY,USA)、大鼠 DNase I 酶联免疫吸附试剂盒(LSBio,Seattle,WA,USA)和人 DNase I 酶联免疫吸附试剂盒(LSBio)。
5. 髓过氧化物酶-DNA 复合物定量
血浆中的髓过氧化物酶(MPO)-DNA 复合物通过 ELISA 定量,如前所述[19]。简单地说,用 5 µg/mL 的髓过氧化物酶多克隆抗体(赛默飞世尔科技公司)预涂具有高蛋白结合能力的 96 孔板(赛默飞世尔科技公司),4°C 过夜。轻轻洗板,加入 100 µL 2% BSA/PBS 溶液进行阻断。将血浆按 1:10 稀释后加入孔中,孵育 2 小时。清洗后,加入 5 µg/mL 的抗 DNA HRP 抗体(ZYMO RESEARCH, Irvine, CA, USA),孵育 1 小时。停止反应,测量 450 nm 处的吸光度。
6. 免疫荧光染色
石蜡切片在二甲苯中脱石蜡,复水并在柠檬酸钠缓冲液(10 mM; pH 6.0)中加热诱导抗原回收 15 分钟。自然冷却后,用水清洗切片,并在 0.5% Triton X-100 溶液中透化切片 15 分钟。然后,将切片在 5%的正常山羊血清中浸泡 1 小时,并与抗 MPO 抗体(1 µg/mL, Abcam, Cambridge, UK)、抗 H3Cit 抗体(1:20,000, Novus Biologicals, Centennial, CO, USA)或抗 NE 抗体(10 µg/mL, Thermo Fisher Scientific)一起孵育过夜。随后,清洗切片并用 Alexa Fluor 594 或 488 结合的二抗孵育 1 小时。加入 DAPI(贝奥特姆)染色细胞核,然后装裱切片并成像。使用 Image J 软件分析图像并量化和分析 H3Cit+ NE+ 阳性区域。
7. 苏木 精和伊红染色
将石蜡切片浸入二甲苯中脱蜡,然后在梯度浓度的乙 醇和水中复水。随后,将切片浸入苏木 精溶液(beyotime)中 5 分钟并用水冲洗。脱水后,切片在二甲苯中清洗并装片观察。肾损伤评分:无肾小管损伤(0)、肾小管损伤<10%(1)、肾小管损伤<10%-25%(2)、肾小管损伤<26%-50%(3)、肾小管损伤<51%-74%(4)和肾小管损伤>75%(5)。
8. 冯-科萨和酸性周期-希夫(PAS)染色
使用 Abcam 公司提供的 Von Kossa 染色试剂盒对石蜡切片中的钙沉积物进行染色。石蜡切片脱蜡后在蒸馏水中复水。将切片浸入 5%硝 酸银溶液中,在紫外线下照射 45 分钟。清洗后,切片在 5%硫代硫 酸钠溶液中孵育 2 分钟,然后用水清洗。然后,切片在核快速红溶液中染色 5 分钟,清洗并脱水。清洗切片并装片观察。晶体沉积面积(黑色区域)用图像 J 软件进行量化。进行周期性酸-希夫(PAS)染色时,在脱蜡和复水后,将切片浸入周期性酸溶液中 10 分钟,用水冲洗并在希夫溶液中染色 30 分钟。随后,切片在淡绿色溶液中孵育 2 分钟,清洗、脱水、清除并装片成像。PAS 染色试剂盒由 Abcam 公司提供。无损伤、≤10%、11-25%、26-45%、46-75%和≥76%的损伤用 0 至 5 级表示。
9. 末端脱氧核苷酸转移酶 dUTP 镍末端标记检测法
使用TUNEL检测试剂盒-HRPDAB(Abcam公司),按照说明书用末端脱氧核苷酸转移酶(TdT)dUTP缺口末端标记(TUNEL)检测肾组织细胞凋亡。简言之,脱蜡和复水后,用蛋白酶 K 溶液处理切片 20 分钟并清洗,在 3% H2O2 中孵育 5 分钟以淬灭内源性过氧化物酶。清洗切片并在 TdT 平衡缓冲液中平衡 30 分钟。然后将 TdT 标记反应混合物涂抹在切片上,室温下孵育 90 分钟。清洗切片,加入终止缓冲液停止反应。5 分钟后,清洗切片,用阻断缓冲液阻断,并在 1 × 结合剂中孵育 30 分钟。制备 DAB 工作溶液并应用于切片,然后进行苏木 精染色。随机选取损伤部位周围的五个区域,使用 Image J 软件对 TUNEL 阳性细胞进行量化和分析。
10. 实时定量逆转录 PCR
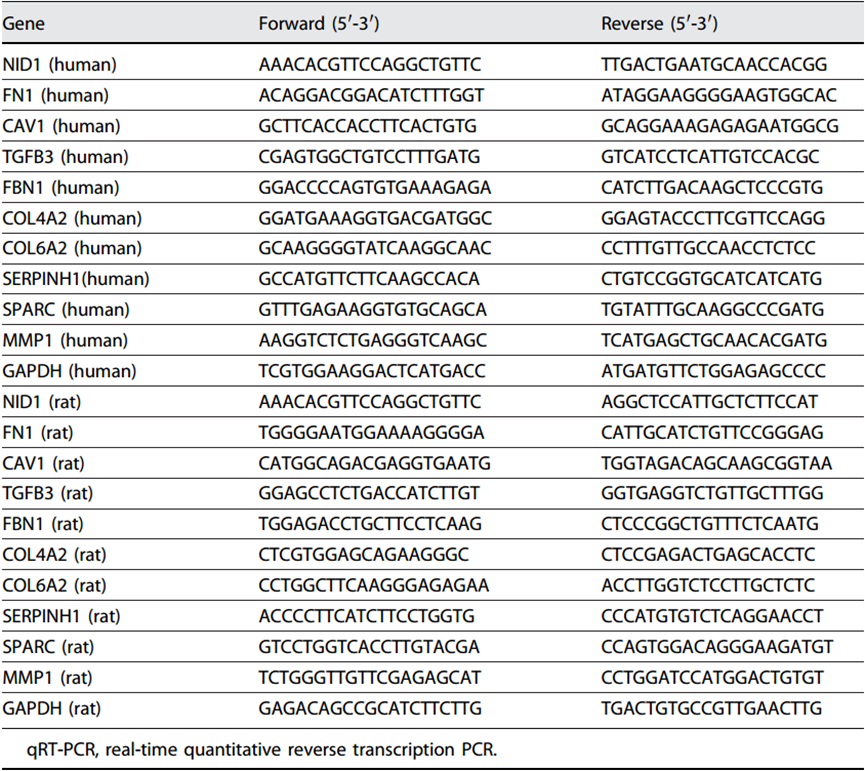
按照生产商的建议,使用高纯度 RNA 组织试剂盒(Sigma-Aldrich,St. Louis,MO,USA)从肾组织中提取总 RNA。通过电泳检测 RNA 质量,并使用 iScript cDNA Synthesis Kit(Bio-Rad,Hercules,CA,USA)反转录为 cDNA。通过实时定量 PCR 测定 CAV1、TGFB3、FBN1、COL4A2、COL6A1、SERPINH1、SPARC、MMP1、NID1 和 FN1 的相对表达。以 GAPDH 作为归一化对照,采用 2-ΔΔCt 法进行计算。引物见表 1。
表 1. 用于 qRT-PCR 的引物序列
11. 肾脏氧化应激和生化指标的评估
SOD 活性和 MDA 含量用于测定肾脏氧化应激。大鼠肾组织在含有 PMSF(0.1 mg/mL)、β-巯基乙 醇(5 mM)和 Triton X-100 (0.5%)的冷 Tris/HCl (0.1 M)中匀浆,在 12,000 g 离心 10 分钟后收集组织提取物。根据制造商的说明,使用超氧化物歧化酶活性检测试剂盒(Sigma-Aldrich)和脂质过氧化(MDA)检测试剂盒(Sigma-Aldrich)测量 SOD 活性和 MDA 含量。血浆中肌酐(Cr)、血尿素氮(BUN)和钙的含量分别由肌酐检测试剂盒(SigmaAldrich)、尿素氮(BUN)比色检测试剂盒(Thermo Fisher Scientific)和钙检测试剂盒(Abcam)测定。
12. 统计分析
实验结果至少来自三次独立实验,以均数±标准差表示。两组和多组的方差分析采用非配对 t 检验和单因素方差分析,P < 0.05 为差异有统计学意义。
参考文献:
Yang Z, Chen X, Qi G, Gu J, Liu Z, Zhang X. Neutrophil Extracellular Traps Drive Kidney Stone Formation. Kidney Dis (Basel). 2024 Nov 21;11(1):11-24. doi: 10.1159/000542471. PMID: 39759764; PMCID: PMC11695979.







