据全球流行病学统计显示,NAFLD的发病率占全球人口的20%~30%,并且呈逐年上升趋势,25%的NAFLD患者可能进展为非酒精性脂肪性肝炎(NASH)。NAFLD疾病谱包括一系列肝脏病变,从非酒精性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)以及肝硬化甚至可能导致肝细胞癌(HCC)的发生,同时还会增加心血管疾病、2型糖尿病(T2DM)、代谢综合征的风险[1]。
目前有学者认为NAFLD的发病机制可能涉及多重因素,先前的“二次打击学说”已不能满足当下对NAFLD的认知,目前较为认可的是“多重打击学说”,这些影响包括胰岛素抵抗、脂肪组织分泌的激素、营养因素、肠道微生物群以及遗传和表观遗传因素。其中肠道菌群失衡和NAFLD的发生密切相关,正常情况下,肠道菌群、宿主与外环境处于动态平衡状态中,在受到内外界环境条件改变下,肠道内微生物种类、数量、功能发生变化导致肠道菌群失衡。
一、肠道菌群与NAFLD的关系
肠道菌群主要包括细菌、古生菌、病毒和真菌等。16SrRNA序列分析结果表明,人体肠道中细菌分属于7个菌门,包括厚壁菌门、拟杆菌门、放线菌门、变形菌门、梭杆菌门、疣微菌门、蓝细菌门。肠道菌群失衡会增加肠道对肠道微生物的通透性,还会导致肝脏暴露于有害物质,促进肝脏脂肪生成和肝纤维化。肠道菌群失调可以引起NAFLD-HCC患者T细胞免疫抑制表型,即调节性T细胞的扩增和CD8+T细胞的衰减。研究发现NAFLD的生化指数肝脏脂肪变性或纤维化评分变化与肠道菌群失调存在关系。
肠道菌群主要是通过其代谢产物对机体产生作用,主要包括短链脂肪酸(SCFAs)、胆汁酸、胺类、吲哚及其衍生物、脂多糖、有机酸以及维生素等,这些代谢产物参与NAFLD的发生发展过程。
二、强肝胶囊调节肠道菌群及代谢物治疗非酒精性脂肪性肝病
中医将 NAFLD 归纳为“胁痛”“积聚”“肝积”“肝癖”范畴。NAFLD 的病因虽然多端,但其病机总以肝脾肾功能失调为本,湿邪、痰浊、瘀血为标。
许多证据表明,肠道细菌可以影响NAFLD的发展。例如,细菌群体组成的变化(称为菌群失调)与肝脏中的几种破坏性作用有关。
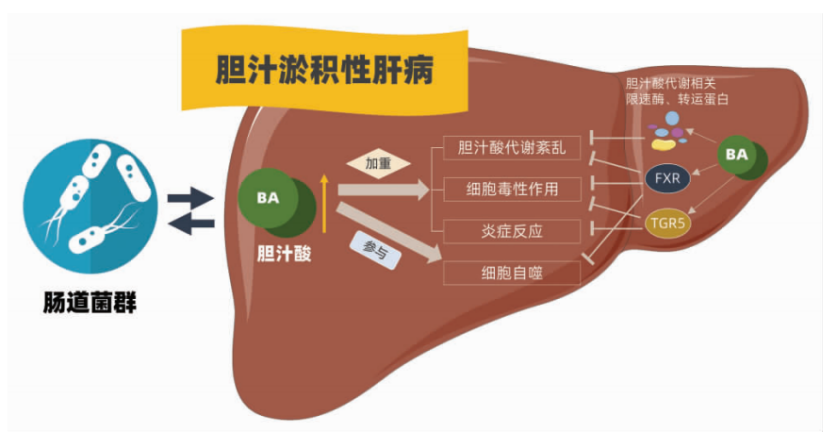
初级胆汁酸在肝细胞合成后与甘氨酸或牛磺酸结合并分泌到胆管中,大部分结合胆汁酸进入肠道,并在回肠末端被重吸收,在顶端钠离子依赖胆汁酸转运蛋白的作用下再次进入肝脏并分泌到胆汁中,即完成“肠肝循环”,进入到回肠和结肠的结合胆汁酸在肠道菌群的作用下代谢形成次级胆汁酸。正常状态下,二者相互协调维持各自稳态,然而肠道菌群的改变又会反过来影响胆汁酸代谢。巨噬细胞可通过提高炎症小体活化破坏肠道渗透性,因此来影响肠道菌群组成及物种丰度,协同胆汁酸促进肝细胞损伤,促进胆汁淤积病变的发展[2]。
在《强肝胶囊提取物通过调节胆汁酸代谢和肠道菌群改善小鼠非酒精性脂肪性肝炎》[3]文献中,通过对肠道微生物群和血清、肝脏和粪便中BA的全面分析,证实强肝胶囊增加了某些肠道菌群的丰度,产生微生物群,上调G蛋白偶联受体表达并抑制核因子-κB(NF-κB)活化,表明强肝胶囊预防非酒精性脂肪性肝炎的潜在机制是调节胆汁酸代谢和肠道微生物群以及抑制炎症反应。
胆汁酸通过多受体、多信号、多途径形成的复杂的分子调控网络调节其自身代谢、炎症反应、细胞毒性、细胞自噬等生物学过程,从而调节CLD的发生发展。另外,胆汁酸与肠道菌群的相互作用在CLD 的发病进程中亦不可被忽视。对胆汁酸代谢在CLD 中作用机制的研究,以及新而高效的药物靶点和药物的研发,将为临床胆汁淤积患者的治疗提供更全面、更科学有效的方案。
参考文献:
[1]王丹,惠登城,孙明瑜,等.中医药调节肠道菌群及代谢物治疗非酒精性脂肪性肝病的研究进展[J].中西医结合肝病杂志,2024,34(07):646-651.
[2]李静,郑葵阳,张蓓蓓.胆汁酸代谢调节胆汁淤积性肝病的作用机制及药物研发[J].临床肝胆病杂志,2021,37(10):2482-2487.
[3]Qiong Lia,Meng Lia,Fenghua Lib,Wenjun Zhoua,Yanqi Danga,Li Zhanga,Guang Jia.Qiang-Gan formula extract improves non-alcoholic steatohepatitis via regulating bile acid metabolism and gut microbiota in mice[J].Journal of Ethnopharmacology,2020,10(258):1-11.







