肠道菌群在非酒精性脂肪性肝病中的研究进展
一、概述
非酒精性脂肪性肝病(NAFLD)被认为是全球范围内最常见的慢性肝脏疾病,它是导致肝转氨酶升高、隐源性肝硬化和肝细胞癌(HCC)的重要原因。据报道NAFLD影响全球约1/4的人口,过去20年间我国NAFLD的发病率总体呈逐年上升趋势,预计截至2030年我国NAFLD患病人数将达31458万例。NAFLD相关HCC发病率增长迅速并造成沉重的医疗负担,美国成人肝移植数据表明2002~2012年NAFLD相关HCC肝移植需求增加近10倍。然而NAFLD发病机制仍不明确,研究发现肠道菌群是导致肝毒性氧化应激的潜在来源。肠道微生物在NAFLD诊断及治疗方面亦具潜力[1]。
二、肠道菌群与NAFLD
肠道菌群是指定居在胃肠道的细菌群落,肠道中有超过1000万亿的细菌,其复杂的基因组是人类基因组的150倍。研究发现NAFLD患者肠道微生物优势菌群发生改变并且微生物组成丰度及多样性降低。相对于健康人群NAFLD患者肠道中拟厚壁菌、变形杆菌水平显著增加。此外拟杆菌及厚壁杆菌比例失调可能与NAFLD发病相关,但其具体比例在不同人种存在差异。肠道菌群组成与NAFLD分期有一定相关性。
三、肠道菌群异常导致胆汁酸代谢改变
肝脏通过经典途径和替代途径将胆固醇转化为胆汁酸。经典途径和替代途径分别通过CYP7A1(胆固醇7α-羟化酶)、CYP27A1(甾醇27-羟化酶)催化初级胆酸和鹅去氧胆酸生成。
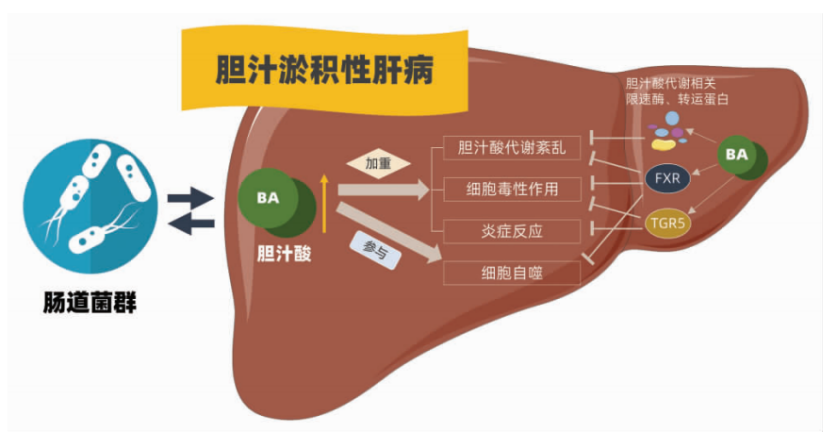
肠道细菌通过解聚、脱羟、氧化和差向异构将初级胆汁酸转换为次级胆汁酸。胆汁酸结合FXR(法尼醇X受体)和TGR5(G蛋白偶联受体5)激活胆汁酸相关的信号通路参与NAFLD/NASH的发展和进展。NAFLD患者血浆胆汁酸的组成特别是血浆甘胆酸、牛磺胆酸和甘鹅去氧胆酸浓度较健康对照组显著升高。乳酸杆菌在肠道中的丰度与血清胆汁酸水平和NAFLD相关肝损伤有关,肠道菌群可通过影响胆汁酸代谢下调FXR信号增强脂肪生成并抑制脂肪酸β-氧化而促进NAFLD。
四、肠道菌群在NAFLD的临床应用
NAFLD可分为单纯性脂肪肝和NASH,前者被认为是非进展性亚型,后者被认为是进展性亚型,可导致肝纤维化、肝硬化、HCC和肝脏相关死亡。合并肝纤维化、肝硬化是导致NAFLD患者不良预后的重要危险因素。NAFLD诊断分期的金标准为肝脏活检,然而有创性及风险性限制了其临床应用。临床广泛应用的超声、肝脏弹性成像判读结果则易受到腹水、体质量干扰。肠道菌群在NAFLD中的特征性变化,表明其具有成为NAFLD无创标志物的潜力。
五、强肝胶囊能调节肠道菌群与胆汁酸代谢
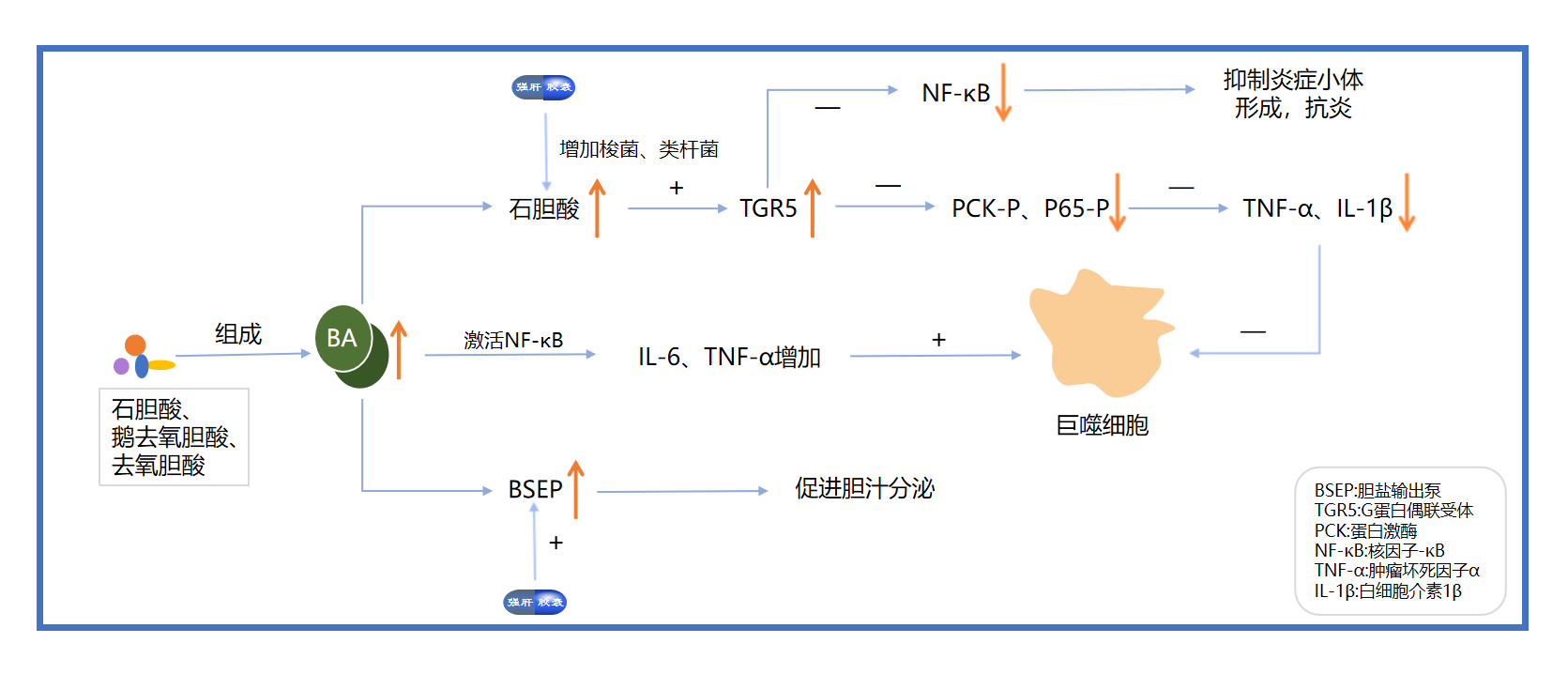
在《强肝胶囊提取物通过调节胆汁酸代谢和肠道菌群改善小鼠非酒精性脂肪性肝炎》[2]文献中,通过对肠道微生物群和血清、肝脏和粪便中BA的全面分析,证实强肝胶囊增加了某些肠道菌群的丰度,产生微生物群,上调G蛋白偶联受体表达并抑制核因子-κB(NF-κB)活化,表明强肝胶囊预防非酒精性脂肪性肝炎的潜在机制是调节胆汁酸代谢和肠道微生物群以及抑制炎症反应。
胆汁酸通过多受体、多信号、多途径形成的复杂的分子调控网络调节其自身代谢、炎症反应、细胞毒性、细胞自噬等生物学过程,从而调节CLD的发生发展。另外,胆汁酸与肠道菌群的相互作用在CLD 的发病进程中亦不可被忽视。对胆汁酸代谢在CLD 中作用机制的研究,以及新而高效的药物靶点和药物的研发,将为临床胆汁淤积患者的治疗提供更全面、更科学有效的方案。
参考文献:
[1]辜雪莲,李俊峰,毛小荣.肠道菌群在非酒精性脂肪性肝病中的研究进展[J].肝脏,2021,26(12):1418-1420.DOI:10.14000/j.cnki.issn.1008-1704.2021.12.033.
[2]Qiong Lia,Meng Lia,Fenghua Lib,Wenjun Zhoua,Yanqi Danga,Li Zhanga,Guang Jia.Qiang-Gan formula extract improves non-alcoholic steatohepatitis via regulating bile acid metabolism and gut microbiota in mice[J].Journal of Ethnopharmacology,2020,10(258):1-11.





